Sie befinden sich hier
Inhalt
Erkrankungen des Herz-Kreislaufsystems sind immer noch die häufigste Todesursache in Industrieländern. Sowohl bei Herzinsuffizienz, Hypertonie und anderen Erkrankungen mit endothelialer Dysfunktion, wie Diabetes mellitus, sind eine gestörte Kommunikation einzelner Zelltypen untereinander sowie Veränderungen in der intrazellulären Signalkaskaden von wichtiger Bedeutung. Heterotrimere G-Proteine und monomere GTPasen sind Schlüsselproteine der Signaltransduktion in allen Zellen des Herz-Kreislaufsystems, die zu Veränderungen im Rahmen von pathologischen Prozessen beitragen.
Wir beschäftigen uns deshalb mit der Analyse solcher Signalwege und deren pathologischen Veränderungen in Endothelzellen, Perizyten und glatten Muskelzellen der Gefäße.
- Ein besonderer Fokus liegt dabei auf dem Enzym Nukleosiddiphosphat-Kinase (NDPK), das über die Bereitstellung von GTP zur Aktivierung von G-Proteinen beiträgt. Die Isoform NDPK B wird zudem zur Ausbildung von Caveolae benötigt und kann als Proteinhistidinkinase andere Proteine, z. B. den Kaliumkanal KCa3.1 phosphorylieren und aktivieren. Mit Hilfe von NDPK B – defizienten Mäusen, NDPK B - Depletion in Zebrafischembryonen und kultivierten Endothel- und glatten Gefäßmuskelzellen charakterisieren wir die Bedeutung des Enzyms in der vaskulären Biologie. Da wir bereits eine Bedeutung der NDPK B in der diabetischen Retinopathie, bei der Neubildung von Gefäßen sowie der Ausbildung einer Neointima nach Gefäßverletzung zeigen konnten, möchten wir es als molekulares Target für niedermolekulare Hemmstoffe etablieren.
- Die Aktivierung monomerer GTPasen erfolgt über sogenannte Guaninnukleotidaustauchfaktoren (GEFs). Zusammen mit GTPase-aktivierenden Proteinen (GAPs) determinieren diese GEFs die Aktivität monomerer GTPasen und damit die entsprechenden zellulären Antworten wie Migration und Proliferation. Es wird dabei zunehmend klar, dass die lokale Aktivität der monomeren GTPasen in entsprechenden subzellulären Kompartimenten maßgeblich für das zelluläre Verhalten bzw. pathologische Veränderungen ist. Wir interessieren uns in diesem Zusammenhang z.B. für die Steuerung der lokalen Aktivität der GTPasen RhoA durch das bisher wenig charakterisierte GEF RhoGEF17 und das GAP p190RhoGAP an den adherens junctions der Endothelzellen. Im selben Zusammenhang untersuchen wir das cAMP-abhängige Rap-GEF EPAC1.
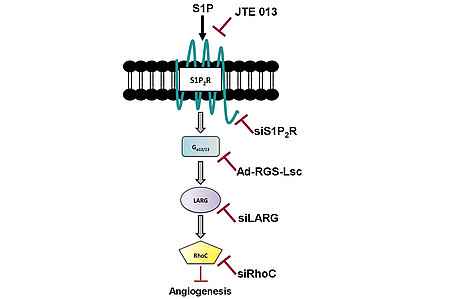
Schematische Darstellung eines neuen Signalwegs im menschlichen Endothelzellen, der die S1P2-Rezeptor-induzierte Aktivierung von RhoC und damit die Hemmung der Angiogenese durch Sphingosin-1-Phosphat vermittelt. Die in der Studie “The activation of RhoC in vascular endothelial cells is required for the S1P receptor type 2-induced inhibition of angiogenesis” (Cell Signal. 25: 2478-2484, 2013) zur Identifizierung der Komponenten des Signalwegs verwendeten Hemmstoffe und -techniken sind eingezeichnet.
Eigene relevante Publikationen
- Qiu Y, Zhao D, Butenschön VM, Bauer AT, Schneider SW, Skolnik EY, Hammes HP, Wieland T, Feng Y. Nucleoside diphosphate kinase B deficiency causes a diabetes-like vascular pathology via up-regulation of endothelial angiopoietin-2 in the retina. Acta Diabetol. 53:81-9, 2015.
- Feng Y, Gross S, Wolf NM, Butenschön VM, Qiu Y, Devraj K, Liebner S, Kroll J, Skolnik EY, Hammes HP, Wieland T. Nucleoside diphosphate kinase B regulates angiogenesis through modulation of vascular endothelial growth factor receptor type 2 and endothelial adherens junction proteins. Arterioscler Thromb Vasc Biol. 34: 2292-300, 2014.
- Del Galdo S, Vettel C, Heringdorf DM, Wieland T. The activation of RhoC in vascular endothelial cells is required for the S1P receptor type 2-induced inhibition of angiogenesis. Cell Signal. 25: 2478-2484, 2013.
- Lutz S, Mohl M, Rauch J, Weber P, Wieland T. RhoGEF17, a Rho-specific guanine nucleotide exchange factor activated by phosphorylation via cyclic GMP-dependent kinase Ia. Cell Signal. 25: 630-638, 2013.
- Carbajo-Lozoya J, Lutz S, Feng Y, Kroll J, Hammes HP, Wieland T. Angiotensin II modulates VEGF-driven angiogenesis by opposing effects of type 1 and type 2 receptor stimulation in the microvascular endothelium. Cell Signal. 24: 1261-1269, 2012.
- Hippe HJ, Wolf NM, Abu-Taha HI, Lutz S, Le Lay S, Just S, Rottbauer W, Katus HA, Wieland T. Nucleoside diphosphate kinase B is required for the formation of heterotrimeric G protein containing caveolae. Naunyn Schmiedebergs Arch Pharmacol. 384: 461-472, 2011.
- Wieland T, Hippe HJ, Ludwig K, Zhou XB, Korth M, Klumpp S. Reversible histidine phosphorylation in mammalian cells: a teeter-totter formed by nucleoside diphosphate kinase and protein histidine phosphatase 1. Methods Enzymol. 471: 379-402, 2010.
- Wuertz CM, Lorincz A, Vettel C, Thomas MA, Wieland T, Lutz S. p63RhoGEF - a key mediator of angiotensin II-dependent signaling and processes in vascular smooth muscle cells. FASEB J. 24: 4865-4876, 2010.
- Hippe HJ, Wolf NM, Abu-Taha I, Mehringer R, Just S, Lutz S, Niroomand F, Postel EH, Katus HA, Rottbauer W, Wieland T. The interaction of nucleoside diphosphate kinase B with Gbetagamma dimers controls heterotrimeric G protein function. Proc Natl Acad Sci U S A. 106: 16269-16274, 2009.
- Lutz S, Shankaranarayanan A, Coco C, Ridilla M, Nance MR, Vettel C, Baltus D, Evelyn CR, Neubig RR, Wieland T, Tesmer JJ. Structure of G?q-p63RhoGEF-RhoA complex reveals a pathway for the activation of RhoA by GPCRs. Science 318: 1923-1927, 2007.
Kontextspalte
Kontakt

Prof. Dr. Thomas Wieland
Experimentelle Pharmakologie
European Center of Angioscience
Medical Faculty Mannheim
Ludolf Krehl-Str. 13-17
68167 Mannheim
Telefon 0621 383-71750
thomas.wieland@medma.uni-heidelberg.de