Sie befinden sich hier
Inhalt
Abteilung für Neuroradiologie
Das Aufgabengebiet der Neuroradiologie umfaßt die Diagnostik und Therapie von Erkrankungen des zentralen Nervensystems, wie Gehirn und Rückenmark, des Kopfes einschließlich der Augen, des Halses, der Wirbelsäule und der Muskeln.
Diagnostische Verfahren
Für die Diagnostik stehen die Verfahren
- Computertomographie
- Magnetresonanztomographie
- konventionelle Funktionsaufnahmen der Wirbelsäule
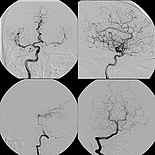
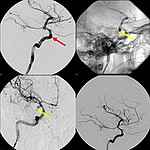
- Katheterangiographie (digitale Subtraktionsangiographie, DSA)
zur Verfügung. Diese Verfahren kommen sowohl in der Erstdiagnostik und Verlaufskontrolle von Erkrankungen, aber auch in der Planung neurochirurgischer Operationen oder der Strahlentherapie zum Einsatz.
Therapeutische Verfahren
Therapeutische Verfahren der Neuroradiologie sind:
- Behandlung von Aneurysmen
- Erweiterung von Einengungen oder Verschlüssen der hirnversorgenden Gefäße
- Schmerztherapie bei Rückenschmerzen (Facettenblockade)
Mittels CT-gesteuerter Punktion können zudem Gewebsproben gewonnen werden.
Kontextspalte
Moderne Schlaganfalltherapie der Neuroradiologie | Vortrag von PD Dr. med. Eva Neumaier-Probst
Sprechstunden und Termine
Ambulanter Termin
Telefon 0621/383-2443
Neuroradiologische &
Neurovaskuläre Sprechstunde
Prof. Dr. med. Christoph Groden
Mittwochs 13:00 bis 15:00 Uhr
Telefon 0621/383-2443
Computertomorgraphie
Funktionsröntgen
Myelographie
CT-gesteuerte Schmerztherapie
Magnetresonanztomographie
Angiographie
Überweisungsschein und Ergebnisse von Voruntersuchungen bitte mitbringen.
Telefon 0621/383-2793
Befundanfragen
Kopien von Befunden können Sie im Sekretariat angefordern.
Telefon 0621/383-2443
Aus Datenschutzgründen muss eine schriftliche Einverständniserklärung des Patienten zur Befundübermittlung an uns gesendet werden.
Telefax 0621/383-2165