Sie befinden sich hier
Inhalt
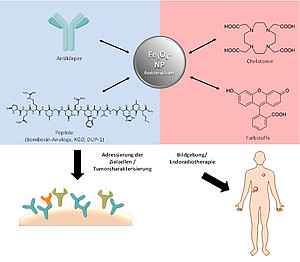
Entwicklung multimodaler Theranostika
Ziel der Arbeiten, die in Kooperation mit dem Fraunhofer Institut für Produktionstechnik und Automatisierung (IPA), Projektgruppe für Automatisierung in der Medizin und Biotechnologie (PAMB) durchgeführt werden, ist die Entwicklung von Theranostika, die in vitro und in vivo zur Charakterisierung von Tumorzellen mittels multimodaler Bildgebung und anschließend zur patientenindividualisierten Endoradiotherapie verwendet werden können. Exemplarisch sollen dabei Arbeiten an Prostatakarzinom-spezifischen Biomarkern durchgeführt werden, da das Prostatakarzinom mit 26% die häufigste Krebserkrankung bei Männern in Deutschland und mit 10% die dritthäufigste Krebstodesursache darstellt.
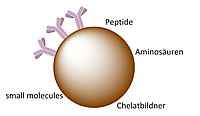
Grundlage der zu entwickelnden Theranostika ist die Funktionalisierung magnetischer Eisenoxidnanopartikel, wobei die funktionellen Gruppen Verknüpfungsmöglichkeiten für Biomoleküle wie Antikörper oder Peptide, die spezifisch an auf Prostatakarzinomen (über-)exprimierten Rezeptoren binden, mittels spezifischer und effizienter Reaktionen zur Verfügung stellen sollen. Die magnetischen Eisennanopartikel können durch Konjugation der spezifisch bindenden Liganden für verschiedene Applikationen verwendet werden:
- Analyse der Rezeptorexpression auf Tumorzellen/Zielzellen. Die Bindung der Eisenpartikel-Liganden soll nach Inkubation mit den Zellen quantifiziert und so die Zielmolekülexpression auf der Tumorzelloberfläche bestimmt werden.
- Aufreinigung der Tumorzellen nach Bindung der superparamagnetischen Eisennanopartikel mittels magnetischen Zellseparationstechnologien
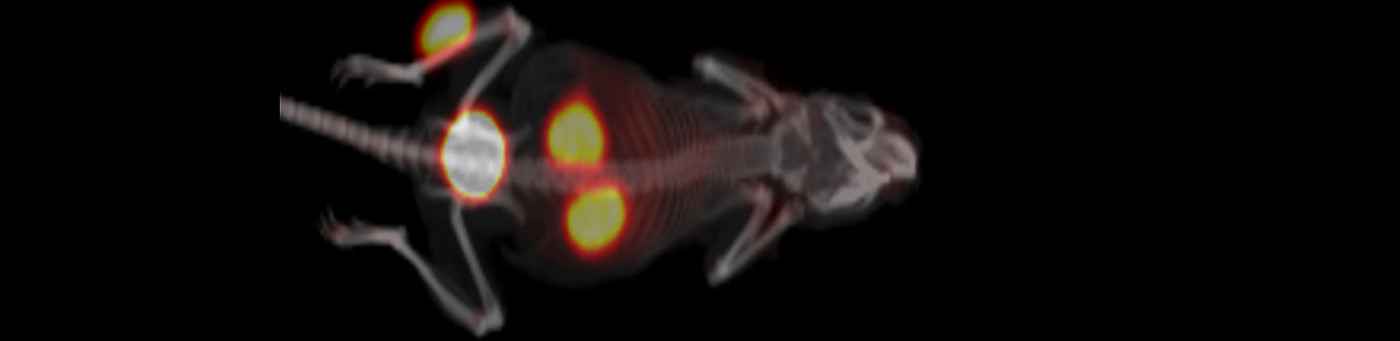
- Einsatz als multimodales Kontrastmittel. Durch die super-paramagnetischen Eigenschaften der Eisennanopartikel kann eine nicht-invasive und tumorspezifische Bildgebung mittels MRT erfolgen. Weiterhin kommen durch Einführung von Chelatoren auf der Oberfläche der Partikel eine Radiomarkierung und damit eine PET-Bildgebung wie auch ein Einsatz als Endoradiotherapeutikum im Betracht. Durch Kombination mit Fluoreszenzfarbstoffen wird zusätzlich eine Anwendung in der Optischen Bildgebung ermöglicht.
Funktionalisierte Nanopartikel zur kontrastmittelverstärkten molekularen Bildgebung mittels CT
Für die Computer-Tomographie (CT) sind bislang keine spezifisch anreichernden Kontrastmittel verfügbar, wodurch das volle Potenzial der Methode nicht ausgenutzt werden kann. Ziel der Arbeiten ist daher die Entwicklung spezifisch anreichernder CT-Kontrastmittel. Für diesen Zweck sind beispielsweise bestimmte Nanopartikel geeignet, die eine starke Schwächung der Röntgenstrahlung bewirken und sich durch hohe chemische Stabilität, geringe Toxizität und eine leicht zu funktionalisierende Oberfläche auszeichnen.
Aufgrund dieser Eigenschaften haben funktionalisierte Partikel großes Pozential für den Einsatz als Basis für die molekulare Bildgebung mittels CT. Für eine spezifische Anreicherung müssen die Partikel jedoch mit verschiedenen, im Zielgewebe spezifisch anreichernden bioaktiven Molekülen stabil gecoatet werden. Die so erhaltenen Kontrastmittel werden anschließend hinsichtlich ihrer Eignung in der spezifischen CT-Bildgebung untersucht.
Entwicklung neuer Radiopharmaka für die PET-Diagnostik und Therapie maligner Erkrankungen und Untersuchung der Übertragbarkeit der Ergebnisse auf den humanen Organismus
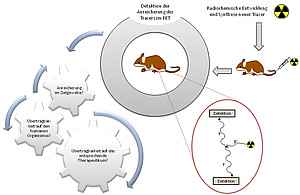
Die targetspezifische molekulare Bildgebung mittels Positronen-Emissions-Tomographie (PET) hat aufgrund ihrer hohen Sensitivität und Quantifizierbarkeit eine zunehmende Bedeutung für die Diagnostik verschiedenartiger Erkrankungen gewonnen, so dass ein wachsender Bedarf an geeigneten Radiopharmaka besteht. Neben der Entwicklung neuer Positronenemitter-markierter Radiopharmaka, die die Visualisierung der Zielstruktur mit hoher Sensitivität und Selektivität erlauben, ist ein weiterer wichtiger Aspekt die Abschätzung der Verteilung eines neuen Radiopharmakons im humanen Organismus. Dies trifft neben PET-Diagnostika ebenso auf Therapeutika für eine Anwendung in der Endoradiotherapie zu.
Ziel der Arbeiten ist es daher zum einen, neue diagnostische Pharmaka auf der Basis verschiedener Radionuklide für die PET-Bildgebung maligner Erkrankungen zu entwickeln, herzustellen, in vitro und in vivo zu untersuchen. Darüber hinaus wird mittels physiologisch basierter pharmakologischer Modellierung ermittelt, inwieweit sich die erhaltenen experimentellen Daten auf den humanen Organismus übertragen lassen, ob sich also die neu entwickelten Radiopharmaka für eine Anwendung am Menschen eignen. Dies soll ermöglichen, neu entwickelte Verbindungen schneller und mit geringerem Risiko in die klinische Anwendung übertragen zu können. Entsprechende Arbeiten werden ebenfalls mit entsprechenden therapeutischen Verbindungen durchgeführt, um neben der Diagnose auch die Therapie verschiedener maligner Erkrankungen zu verbessern.
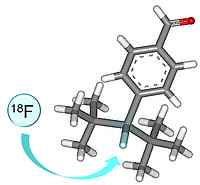
Entwicklung neuer auf der 18F-SiFA-Technologie basierender Radiotracer für die onkologische Bildgebung mittels PET
Radioaktive Markierungsreaktionen vor allem bioaktiver Verbindungen wie beispielsweise Peptiden mit dem Positronenemitter [18F]Fluorid erfordern in der Regel mehrere Reaktions- und Aufreinigungsschritte, wodurch sich die radiochemischen Synthesen als teilweise sehr komplex gestalten.
Mit Hilfe des SiFA-Bausteins (SiFA = Silizium-basierte Fluor-Akzeptoren), der direkt in beispielsweise peptidische Verbindungen eingebracht werden kann, wird eine direkte Radiomarkierung über einen einzigen Reaktionsschritt mittels einer Isotopen-Austauschreaktion von [19F]Fluor mit [18F]Fluor möglich.
Bislang konnte dieser Ansatz auf verschiedene tumoraffine Peptide erfolgreich angewandt werden und durch kontinuierliche Weiterentwicklung sowohl des Moleküldesigns als auch der Radiomarkierung selbst konnten 18F-radiomarkierte Verbindungen mit teilweise exzellenten in vitro und in vivo Eigenschaften (sehr gute Anreicherung im Tumor bei sehr geringer Hintergrundanreicherung) erhalten werden. Weiterer Vorteil dieser Methode ist die damit ermöglichte Kit-ähnliche, sehr effiziente Synthese peptidischer Rezeptor-Liganden für die personalisierte Diagnostik onkologischer Fragestellungen.
Entwicklung einer neuen 89Zr-Radiomarkierungschemie für die Anwendung von 89Zr in der humanen in vivo PET-Bildgebung
Ziel des in Kooperation mit der Hochschule Mannheim und der Zyklotron AG Karlsruhe durchgeführten Forschungsprojektes ist die Entwicklung neuer Radiotracer auf Basis des Radionuklides 89Zr für die Positronen-Emissions-Tomographie.
89Zr stellt aufgrund seiner langen Halbwertszeit von 78h, seines 22.3%igen Positronenbranchings und seiner mittleren Positronenenergie, die zwischen denen von 18F und 68Ga liegt, ein vorteilhaftes Nuklid für die PET-Bildgebung dar. Weiterhin lässt es sich am Zyklotron durch Bestrahlung von stabilem, hochreinem 89Y in einer 89Y(p,n)89Zr Reaktion erhalten.
Aufgrund seiner Halbwertszeit ist es vor allem zur nicht-invasiven Visualisierung der Bioverteilung langsam akkumulierender Biomoleküle, wie beispielsweise Antikörpern, die sich mit hoher Tumorspezifität und damit erreichbaren hohen Tumor-zu-Hintergrund-Verhältnissen für die Visualisierung maligner Erkrankungen anbieten, besonders geeignet.
Da die derzeit verwendete Komplexierungschemie für 89Zr jedoch Nachteile vor allem hinsichtlich der geringen Stabilität der geformten 89Zr-Komplexe aufweist, wird im Rahmen dieses Projektes eine Verbesserung der bereits bekannten Komplexbildner angestrebt, um die in vivo Pharmakokinetik der 89Zr-radiomarkierten Substanzen zu optimieren und das volle diagnostische Potenzial dieses Radionuklides für die PET ausnutzen zu können.
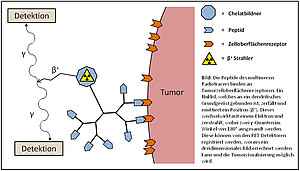
Entwicklung neuer multimerer tumoraffiner Peptide für die in vivo Detektion maligner Erkrankungen mittels PET
Monomere rezeptoraffine Peptide, die spezifisch an auf Tumorzellen überexprimierte Rezeptoren binden, weisen häufig eine zu geringe in vivo Stabilität oder zu geringe Tumor-zu-Hintergrund-Verhältnisse auf, was ihre Anwendung in der in vivo PET-Bildgebung maligner Erkrankungen limitiert.
Durch die Multimerisierung dieser Peptide können allerdings stabilisierte Substanzen erhalten werden, die spezifisch und mit hoher Affinität an den Tumor binden und somit eine hohe Anreicherung im Tumor erlauben. Durch Radiomarkierung mittels Positronenstrahler können somit wertvolle neue Radiotracer mit verbesserten in vivo Eigenschaften für die PET erhalten werden.
Hierfür werden zunächst dendritische Grundgerüste hergestellt, auf deren Basis die Multimerisierung der spezifisch anreichernden monomeren Peptide erfolgt. Anschließend erfolgen die Einführung eines Chelatbildners und die Radiomarkierung mit einem Positronenemitter für eine Anwendung der Substanzen in vivo. Die so hergestellten neuen Peptid-Multimere werden im Folgenden im Zellversuch auf ihre Tumorzellbindungseigenschaften hin untersucht und anschließend ihre Eignung für eine in vivo Tumorbildgebung mittels PET ermittelt.
Apoptose und ihre nicht-invasive Bildgebung mittels PET
Ziel der Arbeiten ist die Etablierung eines 18F-markierten PET-Tracers zur nicht-invasiven Bildgebung von Apoptose. Die nicht-invasive Bildgebung apoptotischer Prozesse ist für die klinische Behandlung wertvoll, da die Schwere des Krankheitsverlaufes und die Prognose bei verschiedenen akuten Erkrankungen, wie beispielsweise Herzinfarkt, abgeschätzt werden kann. Weiterhin kann eine Therapie der Erkrankung verfolgt und die Behandlungseffizienz ermittelt werden. Dies ist vor allem deshalb vorteilhaft, da apoptotische Veränderungen meist deutlich vor einer morphologischen Veränderung auftreten und somit der Verlauf einer Erkrankung sehr frühzeitig abgeschätzt werden kann.
Weiterhin basieren bei der Behandlung von malignen Erkrankungen zahlreiche Therapiestrategien auf der Induktion von Apoptose, wodurch eine effiziente Apoptosebildgebung ein wertvolles Instrument zur Darstellung des Therapieansprechens darstellt.
Die in vivo Apoptose-Detektion mittels PET lässt sich mit 18F-markierten, spezifisch auf die Veränderungen apoptotischer Zellen reagierenden small molecules realisieren.
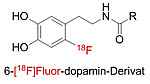
Entwicklung von 18F-markierten Dopamin-Derivaten zur Verfolgung der Anreicherung in Spendernieren
Ziel der Arbeiten ist die Entwicklung eines 18F-markierten, auf Dopamin basierenden Radiotracers für die PET Bildgebung. Im klinischen Betrieb werden Nierenspender vor einer Nierenentnahme für die Transplantation einer Behandlung mit Dopamin unterzogen. Durch das Erreichen eines erhöhten Dopaminspiegels in den Spendernieren müssen neben anderen positiven Effekten signifikant weniger Dialysen bei den Nierenempfängern nach erfolgter Transplantation durchgeführt werden. Die Dauer und der Mechanismus des protektiven Effektes der Dopamin-Behandlung sind jedoch unklar.
Weiterhin zeigt sich, dass unterschiedliche Derivate des Dopamins unterschiedliche Wirksamkeit hinsichtlich Nierenprotektion aufweisen und dass Nebenwirkungen, die im Falle des Dopamins beobachtet werden, zumindest teilweise vermieden werden können.
Daher sollen Radiotracer auf der Basis verschiedener Dopamin-Derivate entwickelt und hinsichtlich ihrer Eignung zur Aufklärung des Mechanismus der Nierenprotektion und ihre Anreicherung und Metabolisierung untersucht werden. Auf der Basis dieser Ergebnisse können anschließend gezielt Substanzen mit noch stärkerer Nieren protektiver Wirkung entwickelt werden.