Sie befinden sich hier
Inhalt
Grundlagenforschung zur Interaktion hämatopoetischer Stammzellen mit der Nische
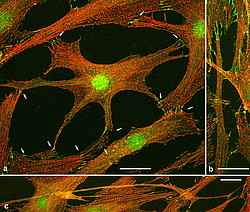
Die zelluläre Interaktion mit der Umgebung bestimmt das Schicksal humaner hämatopoetischer Stammzellen (HSC). Insbesondere die Regulation zwischen Differenzierung und Selbsterneuerung erfordert eine fein ausbalancierte Kommunikation mit der Stammzellnische im Knochenmark. Zahlreiche lösliche wie auch zelluläre Determinanten spielen dabei eine Rolle.
Ziel der Arbeitsgruppe ist die Identifikation und Charakterisierung dieser Determinanten. Dazu werden humane Primärzellen eingesetzt: HSC aus Nabelschnurblut, mobilisiertem peripheren Blut sowie Knochenmarkaspirat; als Nischenzellen dienen humane mesenchymale Stromazellen (MSC) aus dem Knochenmark. In Kokulturmodellen konnte der Einfluss direkter Zellkontakter sowie bestimmter Chemokine komparativ bestimmt werden. In darauf aufbauenden 3D-Nischen-Modellsystemen wird zudem die dreidimensionale Bälkchenstruktur des Knochenmarks nachempfunden um somit ein physiologischeres Nischenmodell zu entwickeln. In Modellsystemen können in-vitro lösliche Faktoren und Reagenzien zur Stammzellmobilisierung sowie zur Induktion von Differenzierung funktionell getestet werden.
Übergeordnetes Ziel dieser Arbeiten ist nicht nur ein besseres zellbiologisches Verständnis der Interaktion hämatopoetischer Stammzellen mit der Stammzellnische, sondern auch die präklinische Identifikation und Charakterisierung von Reagenzien zur Stammzell¬mobilisierung und Differenzierung.
Klinische Forschung zur Optimierung und Benchmarking der Mobilisierung und Sammlung von hämatopoetischen Stammzellen
Im klinischen Kontext steht die Optimierung der Mobilisierung und Sammlung hämatopoetischer Stammzellen von autologen und allogenen Spendern zum Zwecke der Stammzelltransplantation im Fokus. In mehreren Arbeiten zusammen mit Kollegen der Inneren Medizin III der UMM und der Abteilung Innere Medizin V des Universitätsklinikums Heidelberg wurden Sammlungs- und Transplantationsdaten im Kontext der Hochdosis-Chemotherapie und autologen Stammzelltransplantation systematisch analysiert.
Es wurden Verfahren zum Benchmarking der Leukapherese evaluiert und weiterentwickelt, z.B. anhand einer prädiktiven Formel zur Abschätzung des Sammlungsergebnisses bei autologen und allogenen Stammzellspendern. Zudem wurde der Einsatz von Plerixafor als präemptive oder „Rescue“-Therapie bei Patienten mit nicht ausreichender Stammzell-Mobilisierung untersucht. Auch das Timing der Mobilisation, sowie die Effizienz verschiedener G-CSF-Präparate (Filgrastim, Lenograstim, Biosimiliar) wird untersucht. Ein weiteres Ziel ist die Optimierung der Stammzellprozessierung und Kryokonservierung.
Publikationen
- Kriegsmann K, Schmitt A, Kriegsmann M, Bruckner T, Anyanwu A, Witzens-Harig M, Müller-Tidow C, Klein S, Wuchter P. Orchestration of chemomobilization and G-CSF administration for successful hematopoietic stem cell collection. Biol Blood Marrow Transplant. 2018 Jan 17. [Epub ahead of print]
- Lisenko K, Baertsch MA, Meiser R, Pavel P, Bruckner T, Kriegsmann M, Schmitt A, Witzens-Harig M, Ho AD, Hillengass J, Wuchter P.
Comparison of biosimilar filgrastim, originator filgrastim and lenograstim for autologous stem cell mobilization in patients with multiple myeloma. Transfusion. 2017 Oct;57(10):2359-2365. - Baertsch MA, Schlenzka J, Lisenko K, Krzykalla J, Becker N, Weisel K, Noppeney R, Martin H, Lindemann HW, Haenel M, Nogai A, Scheid C, Salwender H, Fenk R, Graeven U, Reimer P, Schmidt-Hieber M, Goerner M, Schmidt-Wolf IGH, Klein S, Ho AD, Goldschmidt H, Wuchter P. Cyclophosphamide-based stem cell mobilization in relapsed multiple myeloma patients: A subgroup analysis from the phase III trial ReLApsE. Eur J Haematol. 2017 Jul;99(1):42-50.
- Lisenko K, Pavel P, Kriegsmann M, Bruckner T, Hillengass J, Goldschmidt H, Witzens-Harig M, Ho AD, Wuchter P. Storage Duration of Autologous Stem Cell Preparations Has No Impact on Hematopoietic Recovery after Transplantation. Biol Blood Marrow Transplant. 2017 Apr;23(4):684-690.
- Wuchter P, Hundemer M, Schmitt A, Witzens-Harig M, Pavel P, Hillengass J, Goldschmidt H, Ho AD, Lisenko K. Performance assessment and benchmarking of autologous peripheral blood stem cell collection with two different apheresis devices. Transfus Med. 2017 Feb;27(1):36-42.
- Lisenko K, Pavel P, Bruckner T, Puthenparambil J, Hundemer M, Schmitt A, Witzens-Harig M, Ho AD, Wuchter P. Comparison between intermittent and continuous Spectra Optia leukapheresis systems for autologous peripheral blood stem cell collection. J Clin Apher. 2017 Feb;32(1):27-34.
- Wuchter P, Saffrich R, Giselbrecht S, Nies C, Lorig H, Kolb S, Ho AD, Gottwald E. Microcavity arrays as an in vitro model system of the bone marrow niche for hematopoietic stem cells. Cell Tissue Res. 2016 Jun;364(3):573-84.
- Wuchter P, Vetter M, Saffrich R, Diehlmann A, Bieback K, Ho AD, Horn P. Evaluation of GMP-compliant culture media for in vitro expansion of human bone marrow mesenchymal stromal cells. Exp Hematol. 2016 Jun;44(6):508-18.
- Lisenko K, Stadtherr P, Bruckner T, Pavel P, Heilig C, Schmitt A, Puthenparambil J, Brandt J, Ho AD, Dreger P, Witzens-Harig M, Wuchter P. Bone marrow harvesting of allogeneic donors in an outpatient setting: a single-center experience. Biol Blood Marrow Transplant. 2016 Mar;22(3):470-4.
- Wuchter P, Bieback K, Schrezenmeier H, Bornhäuser M, Müller LP, Bönig H, Wagner W, Meisel R, Pavel P, Tonn T, Lang P, Müller I, Renner M, Malcherek G, Saffrich R, Buss EC, Horn P, Rojewski M, Schmitt A, Ho AD, Sanzenbacher R, Schmitt M. Standardization of GMP-compliant production of bone marrow derived human mesenchymal stromal cells (MSCs) for immunotherapeutic applications. Cytotherapy. 2015 Feb;17(2):128-139.
Kontextspalte
Leitung

Prof. (APL) Dr. med. Patrick Wuchter
Telefon 06213706-9581
patrick.wuchter@medma.uni-heidelberg.de
Mitglieder
Dipl.-Biol. Anke Diehlmann
Britta Pflästerer
Claudia Schweter
Steffi Brechtel