Sie befinden sich hier
Inhalt
Forschungsschwerpunkte
ZELLTHERAPIE IN DER REGENERATIVEN MEDIZIN
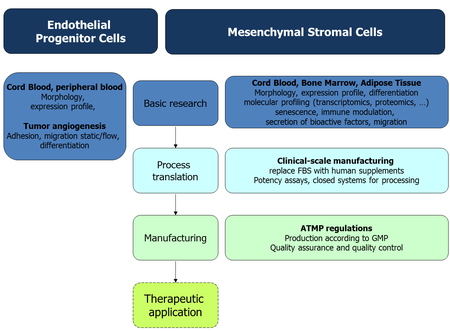
Unser zentrales Forschungsinteresse gilt der regenerativen Medizin, insbesondere der Entwicklung neuartiger zell-basierter Therapien (advanced therapy medicinal products - ATMP). Aufgrund ihres Potentials in der Zelltherapie beschäftigen uns hierbei insbesondere zwei Zellpopulationen: die mesenchymal stromalen Zellen (MSC) und die Endothelvorläuferzellen (EPC). Die Zelltherapie ist so faszinierend, da sie verschiedene Kompetenzen integriert, z. B. Zellbiologie, Immunologie, Medizin, Biotechnologie, medizinische Informatik, Bioanalytik, Prozessentwicklung, Automatisierung.
Speziell interessieren uns:
- der Ursprung und das zelltherapeutische Potential dieser Zellen.
- die Optimierung der proliferativen und funktionellen, speziell der immunmodulierenden und pro-regenerativen, Eigenschaften dieser Zellen für den therapeutischen Einsatz, auch im Rahmen des Tissue Engineerings.
- die Herstellung und Qualitätskontrolle der Zellen entsprechend der Richtlinien der Guten Herstellungspraxis (GMP) für klinische Studien im Bereich der Zelltherapie.
- Humanisierte Zellkultur- und Organmodelle zur Einschränkung von Tierversuchen, z.B. im Bereich der pharmazeutischen Forschung.
www.nmi.de/de/kompetenzen/organ-on-a-chip/3r-netzwerk-baden-wuerttemberg/
EIGENE RELEVANTE PUBLIKATIONEN
- Wuhrer A, Uhlig S, Tuschy B, Berlit S, Sperk E, Bieback K*, Sütterlin M*. Wound Fluid from Breast Cancer Patients Undergoing Intraoperative Radiotherapy Exhibits an Altered Cytokine Profile and Impairs Mesenchymal Stromal Cell Function. Cancers (Basel). 2021;13(9):2140. doi: 10.3390/cancers13092140.
- Torres Crigna A, Fricke F, Nitschke K, Worst T, Erb U, Karremann M, Buschmann D, Elvers-Hornung S, Tucher C, Schiller M, Hausser I, Gebert J, Bieback K. Inter-Laboratory Comparison of Extracellular Vesicle Isolation Based on Ultracentrifugation. Transfus Med Hemother. 2021;48(1):48-59. doi: 10.1159/000508712
- Fiori A, Uhlig S, Klüter H, Bieback K.Human Adipose Tissue-Derived Mesenchymal Stromal Cells Inhibit CD4+ T Cell Proliferation and Induce Regulatory T Cells as Well as CD127 Expression on CD4+CD25+ T Cells. Cells. 2021;10(1):58. doi: 10.3390/cells10010058.
- Torres Crigna A, Uhlig S, Elvers-Hornung S, Klüter H, Bieback K. Human Adipose Tissue-Derived Stromal Cells Suppress Human, but Not Murine Lymphocyte Proliferation, via Indoleamine 2,3-Dioxygenase Activity. Cells. 2020 Nov 5;9(11):2419. doi: 10.3390/cells9112419.
- Kremer H, Gebauer J, Elvers-Hornung S, Uhlig S, Hammes HP, Beltramo E, Steeb L, Harmsen MC, Sticht C, Klueter H, Bieback K, Fiori A. Pro-angiogenic Activity Discriminates Human Adipose-Derived Stromal Cells From Retinal Pericytes: Considerations for Cell-Based Therapy of Diabetic Retinopathy.Front Cell Dev Biol. 2020;8:387. doi: 10.3389/fcell.2020.00387.
- Fiori A, Hammes HP, Bieback K. Adipose-derived mesenchymal stromal cells reverse high glucose-induced reduction of angiogenesis in human retinal microvascular endothelial cells. Cytotherapy. 2020;22(5):261-275. doi: 10.1016/j.jcyt.2020.02.005.
- Rendra E, Scaccia E, Bieback K. Recent advances in understanding mesenchymal stromal cells. F1000Res. 2020;9:F1000 Faculty Rev-156. 10.12688/f1000research.21862.1
- Schäfer R, Schwab M, Siegel G, von Ameln-Mayerhofer A, Buadze M, Lourhmati A, Wendel HP, Kluba T, Krueger MA, Calaminus C, Scheer E, Dominici M, Grisendi G, Doeppner TR, Schlechter J, Finzel AK, Gross D, Klaffschenkel R, Gehring FK, Spohn G, Kretschmer A, Bieback K, Krämer-Albers EM, Barth K, Eckert A, Elser S, Schmehl J, Claussen CD, Seifried E, Hermann DM, Northoff H, Danielyan L. Modulating endothelial adhesion and migration impacts stem cell therapies efficacy.EBioMedicine. 2020 Oct;60:102987. doi: 10.1016/j.ebiom.2020.102987.
- Rigon M, Hörner SJ, Straka T, Bieback K, Gretz N, Hafner M, Rudolf R. Effects of ASC Application on Endplate Regeneration Upon Glycerol-Induced Muscle Damage. Front Mol Neurosci. 2020 Jun 23;13:107. doi: 10.3389/fnmol.2020.00107
- Bieback K, Fernandez-Muñoz B, Pati S, Schäfer R. Gaps in the knowledge of human platelet lysate as a cell culture supplement for cell therapy: a joint publication from the AABB and the International Society for Cell & Gene Therapy. Cytotherapy. 2019 Sep;21(9):911-924. doi: 10.1016/j.jcyt.2019.06.006
- Netsch P, Elvers-Hornung S, Uhlig S, Klüter H, Huck V, Kirschhöfer F, Brenner-Weiß G, Janetzko K, Solz H, Wuchter P, Bugert P, Bieback K. Human mesenchymal stromal cells inhibit platelet activation and aggregation involving CD73-converted adenosine. Stem Cell Res Ther. 2018 Jul 4;9(1):184. doi: 10.1186/s13287-018-0936-8.
- van der Valk J, Bieback K, Buta C, Cochrane B, Dirks WG, Fu J, Hickman JJ, Hohensee C, Kolar R, Liebsch M, Pistollato F, Schulz M, Thieme D, Weber T, Wiest J, Winkler S, Gstraunthaler G. Fetal Bovine Serum (FBS): Past - Present - Future. ALTEX. 2018;35(1):99-118. doi: 10.14573/altex.1705101
SICHERHEIT DER HÄMOTHERAPIE
In Kooperation mit der Hochschule Mannheim (Prof. Wiedemann und Prof. Suhr) und dem Karlsruher Institut für Technolgie (Dr. Melzak) bearbeiten wir Fragen zu Lagerungsschäden von Erythrozyten („storage lesion“). Lagerungsschäden gehen mit einer Abnahme des ATP-Gehaltes, der 2,3 DPG Konzentration und der Verformbarkeit der Erythrozytenmembran einher. Ein besseres Verständnis der Zusammenhänge zwischen Morphologie und Lipidzusammensetzung der Erythrozytenmembran ist Ziel dieses neuen, durch die DFG-geförderten Forschungsprojektes.
EIGENE RELEVANTE PUBLIKATIONEN
- Böcker C, Sitzmann N, Halblaub Miranda JL, Suhr H, Wiedemann P, Bieback K, Rudolph M, Klüter H. Non-Inferior Red Cell Concentrate Quality after Repeated Air Rescue Mission Transport for Prehospital Transfusion. Transfus Med Hemother. 2022. DOI: 10.1159/000520650
- Melzak KA, Spouge JL, Boecker C, Kirschhöfer F, Brenner-Weiss G, Bieback K. Hemolysis Pathways during Storage of Erythrocytes and Inter-Donor Variability in Erythrocyte Morphology. Transfus Med Hemother. 2021 Feb;48(1):39-47. doi: 10.1159/000508711.
- Melzak KA, Moreno-Flores S, Bieback K. Spicule movement on RBCs during echinocyte formation and possible segregation in the RBC membrane. Biochim Biophys Acta Biomembr. 2020 May 30;1862(10):183338. doi: 10.1016/j.bbamem.2020.183338.
- Melzak KA, Muth M, Kirschhöfer F, Brenner-Weiss G, Bieback K. Lipid ratios as a marker for red blood cell storage quality and as a possible explanation for donor gender differences in storage quality. Vox Sang. 2020 May 6. doi: 10.1111/vox.12924
- Melzak KA, Uhlig S, Kirschhöfer F, Brenner-Weiss G, Bieback K. The Blood Bag Plasticizer Di-2-Ethylhexylphthalate Causes Red Blood Cells to Form Stomatocytes, Possibly by Inducing Lipid Flip-Flop. Transfus Med Hemother. 2018 Nov;45(6):413-422. doi: 10.1159/000490502.
- Sierra F DA, Melzak KA, Janetzko K, Klüter H, Suhr H, Bieback K, Wiedemann P. Flow morphometry to assess the red blood cell storage lesion. Cytometry A, 2017. doi: 10.1002/cyto.a.23127
Die Arbeitsgruppe ist Mitglied des Mannheim Institute for Innate Immunoscience (MI3) und des Forschungsschwerpunktes Vaskuläre Biologie und in diesem Bereich an zwei Graduiertenkollegen beteiligt:
2. RenalToolBox EU Horizon 2020: Marie Skłodowska-Curie grant agreement No 813839
Darüber hinaus leiten wir FlowCore , die Core Facility für Durchflusszytometrie und Zellsortierung, die 2007 über HBFG-Fördermittel (HBFG 125/698-1) initiiert und 2022 durch FI-EMS-Mittel der Universität Heidelberg erweitert werden konnte. Sie bietet die Möglichkeit zur Zellsortierung (Cell Sorting) sowie zur Durchführung durchflusszytometrischer Analysen.
Kontextspalte
Leitung

Mitglieder
Stefanie Uhlig
(MTLA)
Corinna Thielemann
(BTA)
Hélène Willer
(cand. Dr. med.vet.)
Erika Erika
(cand. Dr. sc. hum)
Eleonora Scaccia
(cand. Dr. sc. hum)
Clemens Böcker
(cand. Dr. sc. hum)
Julian Gebauer
(cand. Dr. med)
RenalToolBox
In dem von der EU als Innovative Training Network geförderten Verbund arbeiten Forscher der Medizinischen Fakultät Mannheim der Universität Heidelberg an vier der fünzehn Forschungsthemen. mehr...