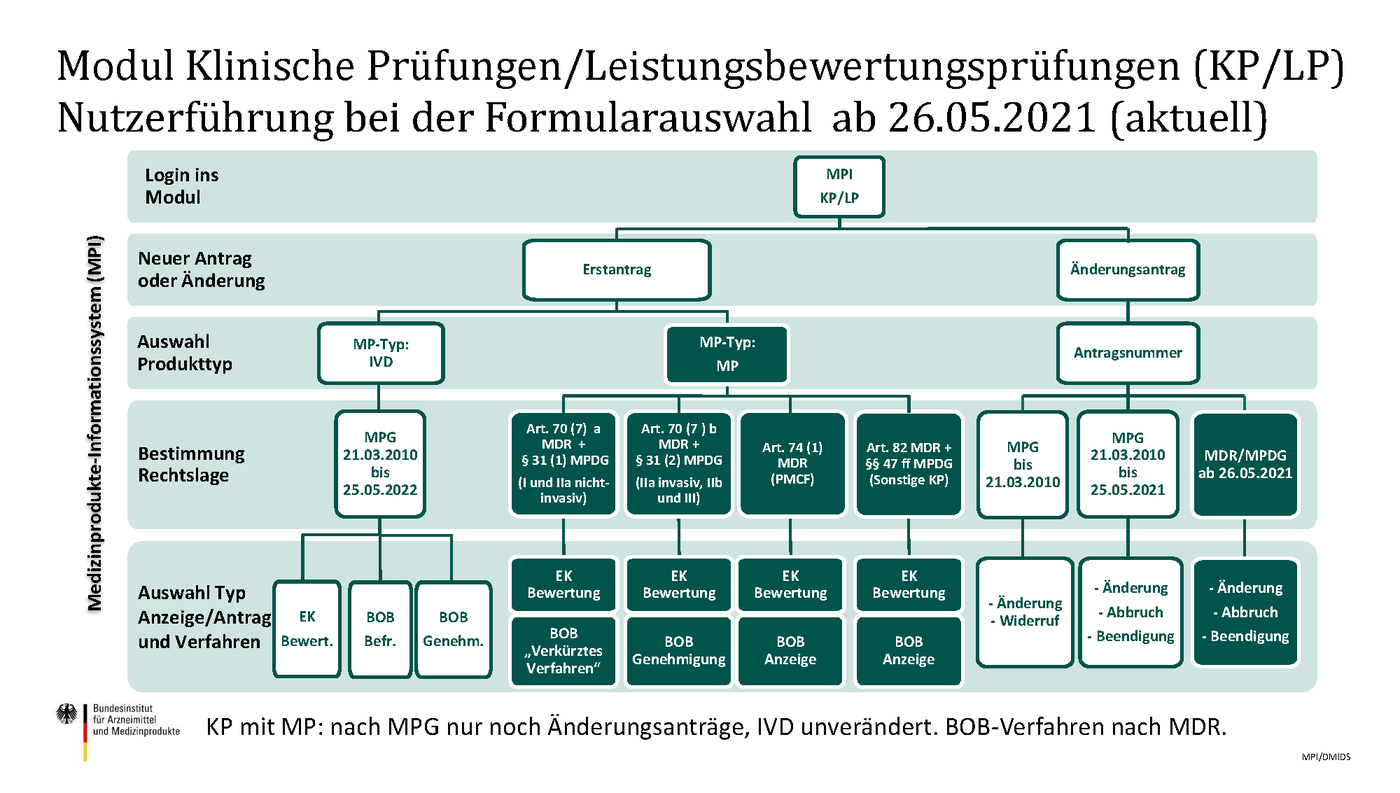
MDR-Studien
Die Verordnung (EU) 2017/745 über Medizinprodukte (MDR) ist ab dem 26. Mai 2021 verpflichtend anzuwenden.
Daher sind klinische Prüfungen, geregelt nach MDR Art. 62–81, MPDG § 31–46, sowie sonstige klinische Prüfungen, die nicht dem Nachweis der Konformität und Leistungsbewertung eines Produktes mit den Anforderungen der MDR dienen, geregelt nach MDR Art. 82, MPDG § 47–61, über das Portal der Bundesoberbehörde einzureichen.
Näheres auf der Webseite der Bundesoberbehörde.
Klinische Prüfung und Leistungsbewertungsprüfung von Medizinprodukten: