Sie befinden sich hier
Inhalt
Plastizität neuronaler Kompartimente und Organellen
Neurone sind stark polarisierte Zellen, die über klar abgrenzbare subzelluläre Kompartimente verfügen. Diese Kompartimente sind mit jeweils charakteristischen strukturellen und funktionellen Eigenschaften versehen. Die wichtigsten neuronalen Kompartimente bestehen aus der somatodendritischen, der axonalen und der synaptischen Domäne. Unsere Studien konzentrieren sich hauptsächlich auf die strukturelle Plastizität des Axons. In erster Linie untersuchen wir hierbei die molekulare Zusammensetzung und strukturelle Plastizität des sogenannten Axoninitialsegment (AIS).
Unsere Schwerpunkte sind
- Neuronale Polarität
- Axonale Plastizität
- Kontakte zwischen Membranem von Organellen
- Role von Peroxisomen bei Neurodegeneration
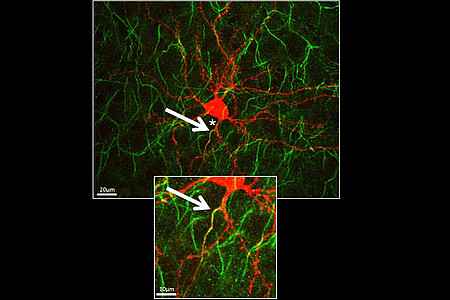
Das AIS entspricht dem ersten Segment des Axons und ist von entscheidender funktioneller Bedeutung als primäre Triggerzone für das Aktionspotenzial. Aktuelle Forschungsdaten zeigen eine erstaunliche stark ausgeprägte Plastizität des AIS: Sowohl die molekulare Zusammensetzung als auch die Länge und Position des AIS werden dynamisch reguliert und tragen offensichtlich zur Regulation der neuronalen Erregbarkeit bei. In diesem Zusammenhang wollen wir die molekulare Basis der strukturellen AIS Plastizität besser verstehen – vor allem im sich entwickelnden Nervensystem. Weiterhin beschäftigen wir uns mit den Mechanismen die dem gerichteten Transport von Zellorganellen zugrunde liegen. Dieser zweite Forschungsansatz unserer Gruppe verfolgt vor allem das Ziel die Rolle von Membrankontakten zwischen Peroxisomen und dem endoplasmatischen Retikulum (ER) in Neuronen zu verstehen.
Neuere Studien zeigen, dass sowohl die Struktur als auch die Funktion des AIS dynamisch reguliert werden. Eine unserer Arbeitshypothesen geht davon aus, dass diese Plastizität auch eine Rolle für die Ausreifung des visuellen Kortex spielt. Tatsächlich zeigt sich eine aus drei Phasen bestehende dynamische Regulation der Länge des AIS während der Ontogenese des visuellen Kortex. Um zu untersuchen, ob diese strukturelle AIS-Plastizität aktivitätsabhängig ist, haben wir visuell deprivierte Mäuse untersucht. Diese Deprivation hat einen deutlichen Einfluss auf die genannten AIS Plastizität und führt dabei vor allem zu einem eher unreifen (verkürzten) Status des AIS. Mit diesen Ergebnissen können wir erstmals eine Aktivitätsabhängigkeit der AIS Plastizität in vivo zeigen. Die Befunde deuten auf einen neuen Mechanismus in der Regulation der neuronalen Aktivität hin.
Kontaktstellen zwischen den Membranen von Peroxisomen und dem endoplasmatischen Retikulum sind seit längerem auf ultrastruktureller Ebene gezeigt worden. Diese Kontaktstellen sind wahrscheinlich von großer Bedeutung für eine große Zahl von physiologische Vorgänge und der Zelle, u.a. auch für den neuronale Transport, den intrazellulären Lipidstoffwechsel und den Austausch von Phospholipiden zwischen benachbarten Biomembranen. Vor kurzem gelang es uns, das peroxisomale Membranprotein (Acyl-CoA bindendes Protein 5; ACBD5) als einen neuen Bindungspartner das ER-assoziierte Membranprotein VAPB zu identifizieren. Hiermit konnte erstmals die molekulare Grundlage für die Etablierung von Membrankontakten zwischen Peroxisomen und ER aufklären.
Der Lehrstuhl für Neuroanatomie wird sich in Zukunft mit folgenden Themen auseinsetzen:
- Rolle der AIS Plastizität für die Entwicklung des visuellen Kortex
- Funktionelle Relevanz der strukturellen AIS Plastizität im somatosensorischen Kortex
- Strukturelle und funktionelle Heterogenität des AIS in kortikalen Neuronen
- Entwicklung von Tiermodellen für time-lapse imaging des AIS
- Funktionelle Relevanz von Membrankontakten zwischen ER und PO
- Funktionelle Rolle der Peroxisomen für neurodegenerative Veränderungen der Retina
Auswahl aktueller Publikationen
- Costello JL, Castro IG, Hacker C, Schrader TA, Metz J, Zeuschner D, Sadeghi A, Godinho LF, Costina V, Findeisen P, Manner A, Islinger M* and Schrader M* (2016) ACBD5 and VAPB mediate membrane associations between peroxisomes and the ER. J. Cell Biol. in press (* shared senior authorship)
- Kubler J, Kirschner S, Hartmann L, Welzel G, Engelhardt M, Herskind C, et al. The HIV-derived protein Vpr52-96 has anti-glioma activity in vitro and in vivo. Oncotarget. 2016.
- Thome C, Kelly T, Yanez A, Schultz C, Engelhardt M, Cambridge SB, et al. Axon-carrying dendrites convey privileged synaptic input in hippocampal neurons. Neuron. 2014;83(6):1418-30.
- Schultz C, Engelhardt M. Anatomy of the hippocampal formation. Front Neurol Neurosci. 2014;34:6-17.
- Gutzmann A, Ergul N, Grossmann R, Schultz C, Wahle P, Engelhardt M. A period of structural plasticity at the axon initial segment in developing visual cortex. Front Neuroanat. 2014;8:11.
- Hirth M, Rukwied R, Gromann A, Turnquist B, Weinkauf B, Francke K, et al. Nerve growth factor induces sensitization of nociceptors without evidence for increased intraepidermal nerve fiber density. Pain. 2013;154(11):2500-11.
- Engelhardt M, Vorwald S, Sobotzik JM, Bennett V, Schultz C. Ankyrin-B structurally defines terminal microdomains of peripheral somatosensory axons. Brain Struct Funct. 2013;218(4):1005-16.
- Sobotzik JM, Sie JM, Politi C, Del Turco D, Bennett V, Deller T, et al. AnkyrinG is required to maintain axo-dendritic polarity in vivo. Proc Natl Acad Sci U S A. 2009;106(41):17564-9.
- Bockhart V, Constantin CE, Haussler A, Wijnvoord N, Kanngiesser M, Myrczek T, et al. Inhibitor kappaB Kinase beta deficiency in primary nociceptive neurons increases TRP channel sensitivity. J Neurosci. 2009;29(41):12919-29.
- Custer SK, Garden GA, Gill N, Rueb U, Libby RT, Schultz C, et al. Bergmann glia expression of polyglutamine-expanded ataxin-7 produces neurodegeneration by impairing glutamate transport. Nat Neurosci. 2006;9(10):1302-11.
Kontextspalte
Kontakt

Prof. Dr. Christian Schultz
Medizinische Fakultät Mannheim
Universität Heidelberg
Ludolf-Krehl-Str. 13-17
68167 Mannheim
Telefon 0621 383-71555
christian.schultz@medma.uni-heidelberg.de
