Sie befinden sich hier
Inhalt
Das Zentralnervensystem (ZNS) wird als ein immunprivilegiertes Organ betrachtet, in dem Immunantworten trotz der Blut-Hirn-Schranke über einen intensiven Austausch mit dem peripheren Immunsystem streng kontrolliert werden. Trotz dieser strengen Kontrolle kann es im ZNS zu Autoimmunerkrankungen kommen. Eine paradigmatische Erkrankung ist die multiple Sklerose (MS). Demgegenüber führen intrinsische Hirntumoren des ZNS, besonders Gliome, durch aktive Prozesse häufig zu einer Immunsuppression.
Die zellulären und molekularen Mechanismen, die zu einer solchen Dysregulation des Immunsystems im ZNS führen, sind nicht gut verstanden, jedoch in beiden Situationen von Bedeutung: Zu viel Immunreaktion bei der MS und zu wenig bei Hirntumoren. Wir interessieren uns daher für die Kontrolle der ZNS-Autoimmunität sowie für immuntherapeutische Ansätze für Hirntumoren und entwickeln hierfür innovative Tiermodelle und arbeiten mit Patientenmaterial. Ziel dieser Arbeiten ist die rasche Translation der Erkenntnisse in klinische Studien.
Immunmodulierende und neuroaktive Funktionen des Tryptophanstoffwechsels
In den letzten Jahren haben wir Schlüsselereignisse im Stoffwechsel der essentiellen Aminosäure Tryptophan als einen endogenen Mechanismus zur Hemmung von Immunreaktionen im Kontext der Hirntumoren sowie einen Schlüsselrezeptor für immunsuppressive endogene Tryptophan-Metabolite identifiziert. Diese Erkenntnisse haben einen neuen Blick auf die Rolle des Tryptophan-Stoffwechsels bei Krebserkrankungen und Autoimmunität sowie neue medikamentöse Angriffspunkte eröffnet.
Die Erkenntnis, dass durch die Aktivität von TDO generierte Tryptophan-Metabolite (Kynurenine) über eine Aktivierung des Arylhydrokarbonrezeptors (AHR) das Wachstum von Tumoren fördern, wirft eine Reihe weiterer Fragen auf, die wir mithilfe neuer MS-Tiermodelle und Tumormodelle zu beantworten versuchen. Ein zentrales Ziel ist die Identifikation von Medikamenten, die als mögliche Behandlung für MS und maligne Gliome in den Tryptophan-Katabolismus eingreifen. Zu diesem Zweck arbeiten wir eng mit industriellen Partnern zusammen.
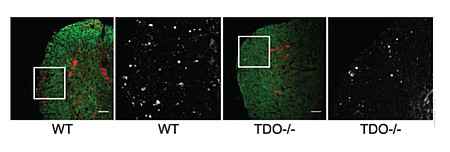
Plastizität und Funktion myeloider Zellen im ZNS
In der Immunantwort gegen Hirntumore besitzen Tumor-infiltrierende myeloide Zellen eine Schlüsselrolle. Obwohl diese Zellen in der Lage sind Immunantworten gegen den Tumor zu initiieren und zu amplifizieren, nutzen Krebszellen die Tumor infiltrierenden myeloiden Zellen, um das Tumorwachstum durch Angiogenese und Immunsuppression zu fördern. Eine hohe Dichte dieser Tumor-infiltrierenden myeloiden Zellen ist assoziiert mit einer schlechten Prognose. Obwohl einige der entscheidenden molekularen Vorgänge in Tumor infiltrierenden myeloiden Zellen bekannt sind, wie die Expression von Checkpoint Inhibitoren auf Makrophagen oder die Aktivierung bestimmter Stoffwechselvorgänge (TDO/IDO Aktivierung) fehlt es dennoch an konkreten Angriffspunkten für eine zielgerichtete Therapie gegen die tumorfördernde Wirkung der myeloiden Zellen.
Ziel unserer Arbeiten ist daher die Identifikation neuer Angriffspunkte zur Modulation der Immunität im ZNS sowohl mit Blick auf Autoimmunität und Tumorimmunität im ZNS als auch im Rahmen neurodegenerativer und psychiatrischer Erkrankungen. Neue bildgebende Parameter sollen bei der Beurteilung der dynamischen Veränderungen dieses Immunkompartiments in Tiermodellen und in Patienten helfen.
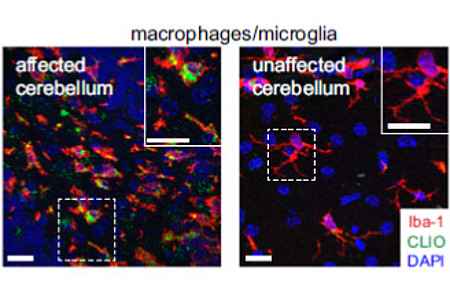
Konfokal Mikroskopiebilder der Iba1+ (rot) Makrophagen / Mikroglia im Cerebellum von Mäusen. Cross-linked iron oxide nanoparticles (CLIO-FITC, grün) wurden 48 Stunden vor der Aufnahme verabreicht. Es zeigen sich in der weißen und grauen Masse von Hirnen des MS Tiermodells dichte Infiltrate von Makrophagen / Mikroglia im Vergleich zu gesunden Tieren. Die meisten der infiltrierenden Zellen haben CLIO-FITC akkumuliert. Kirschbaum et al., PNAS 2016
Antigenspezifische T-Zell-Immunität
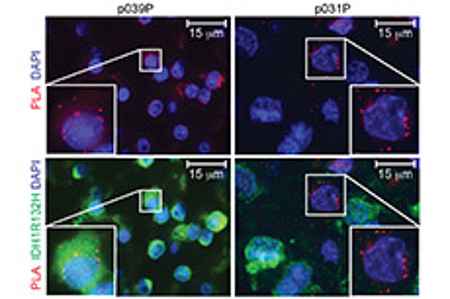
Weitere Untersuchungen befassen sich mit der Entdeckung neuer Ziel-Antigene für die Immuntherapie von Gliomen. Um die Immunogenität einer spezifischen Mutation nachzuweisen, haben wir ein MHC-humanisiertes syngenes Maus-Tumormodell entwickelt sowie eine neue Methode etabliert, um die immunologische Präsentation des mutierten Antigens im Tumorgewebe von Hirntumorpatienten zu detektieren. Damit haben wir spezifische spontane Immunantworten in Hirntumorpatienten sowie die therapeutische Wirksamkeit einer spezifischen Impfung im Mausmodell nachgewiesen.
Auf der Basis dieser Ergebnisse läuft seit Juli 2015 eine klinische Phase I-Studie, die die Immunogenität und Verträglichkeit dieser Vakzine in Hirntumorpatienten testet. Laufende Projekte beschäftigen sich mit (a) dem Wirkmechanismus der Vakzine, (b) der Identifikation weiterer Neoepitope in Hirntumoren für die spezifische Immuntherapie und (c) der konzeptionellen Kombination mit anderen immuntherapeutischen Interventionen wie z.B. Checkpoint Blockade in Hirntumoren. Derzeit arbeiten wir an einem Workflow für die Entwicklung einer Patienten-spezifischen Vakzine für Patienten mit Gliomen basierend auf Mutanom-Analysen und der Identifikation von T-Zell-Rezeptoren.
Im Zentrum unserer Arbeiten stehen
- Kontrolle der Immunität im ZNS
- Regulation der Funktion der antigenspezifischen adaptiven Immunität bei der Neuroinflammation
- Immunmodulierende und neuroaktive Wirkung endogener Tryptophan-Metabolite
- Identifikation neuer immuntherapeutische Ansätze für Hirntumore
- Molekularer Zielpunkte in ZNS-spezifischen myeloiden Zellen
- Analyse von Neoepitopen für Patienten-spezifische Vakzine
Auswahl aktueller Publikationen
- Friedrich M, Sankowski R, Bunse L, Kilian M, Green E, Ramallo Guevara C, Pusch S, Poschet G, Sanghvi K, Hahn M, Bunse T, Münch P, Gegner H, Sonner J, von Landenberg A, Cichon F, Aslan K, Trobisch T, Schirmer L, Abu-Sammour D, Kessler T, Ratliff M, Schrimpf D, Sahm F, Hopf C, Heiland D, Schnell O, Beck J, Böttcher C, Fernandez-Zapata C, Priller J, Heiland S, Gutcher I, Quintana F, von Deimling A, Wick W, Prinz M and Platten M (2021). Nature Cancer https://doi.org/10.1038/s43018-021-00201-z
- Lanz TV, Williams SK, Stojic A, Iwantscheff S, Grabitz C, Becker S, Boehler LI, Mohapatra SR, Sahm F, Kublbeck G, Nakamura T, Funakoshi H, Wick W, Opitz C, Diem R, Platten M (2017). Tryptophan-2,3-Dioxygenase (TDO) deficiency is associated with subclinical neuroprotection in a mouse model of multiple sclerosis. (2017). Sci Rep 24;7:41271
- Kirschbaum K, Sonner J, Zeller M, Deumelandt K, Bode J, Sharma R, Krüwel T, Fischer M, Hoffmann A, Costa da Silva M, Muckenthaler MU, Wick W, Tews B, Chen JW, Heiland S, Bendszus M, Platten M, Breckwoldt MO (2016). In vivo nanoparticle imaging of the innate immune cell compartment can serve as a biomarker of disease severity in a mouse model of multiple sclerosis. (2016). PNAS 113:13227-13232.
- Keil M, Sonner JK, Lanz TV, Oezen I, Bunse T, Bittner S, Meyer HV, Meuth SG, Wick W, Platten M. General control non-derepressible 2 (GCN2) in T cells controls disease progression of autoimmune neuroinflammation. J Neuroimmunol. 2016 Aug 15;297:117-26.
- Osswald M, Jung E, Sahm F, Solecki G, Blaes J, Weil S, Venkataramani V, Horstmann H, Wiestler B, Syed M, Huang L, Ratliff M, Jazi KK, Kurz FT, Schmenger T, Lemke D, Gömmel M, Pauli MA, Liao Y, Häring P, Pusch S, Herl V, Steinhäuser C, Krunic D, Jarahian M, Miletic H, Berghoff A, Griesbeck O, Garaschuk O, Preusser M, Weiss S, Liu H, Heiland S, Platten M, Huber PE, Kuner T, von Deimling A, Wick W, Winkler F (2015). Brain tumor cells interconnect to a functional and resistant network. Nature 528:93-98.
- Bunse L, Schumacher T, Sahm F, Pusch S, Oezen I, Rauschenbach K, Gonzalez M, Solecki G, Osswald M, Capper D, Wiestler B, Winkler F, Herold-Mende C, von Deimling A, Wick W, Platten M. Proximity ligation assay evaluates IDH1R132H presentation in gliomas. J Clin Invest. 2015 Feb;125(2):593-606.
- Schumacher T, Bunse L, Pusch S, Sahm F, Wiestler B, Quandt J, Menn O, Osswald M, Oezen I, Ott M, Keil M, Balß J, Rauschenbach K, Grabowska AK, Vogler I, Diekmann J, Trautwein N, Eichmüller SB, Okun J, Stevanović S, Riemer AB, Sahin U, Friese MA, Beckhove P, von Deimling A, Wick W, Platten M. A vaccine targeting mutant IDH1 induces antitumour immunity. Nature. 2014 Aug 21;512(7514):324-7.
- Bessede A, Gargaro M, Pallotta T, Matino D, Servillo G, Brunacci C, Bicciato S, Mazza EMC, Macchiarulo A, Vacca C, Iannitti R, Tissi L, Volpi C, Belladonna ML, Orabona C, Bianchi R, Lanz T, Platten M, Della Fazia MA, Piobbico D, Zelante T, Funakoshi H, Nakamura T, Gilot D, Denison MS, Guillemin GJ, DuHadaway JB, Prendergast GC, Metz R, Geffard M, Boon L, Pirro M, Iorio A, Veyret B, Romani L, Grohmann U, Fallarino F, Puccetti P, (2014). Aryl hydrocarbon receptor control of a disease tolerance defense pathway. Nature 511:184-192.
- Lanz TV, Becker S, Osswald M, Bittner S, Schuhmann MK, Opitz CA, Gaikwad S, Wiestler B, Litzenburger UM, Sahm F, Ott M, Iwantscheff S, Grabitz C, Mittelbronn M, von Deimling A, Winkler F, Meuth SG, Wick W, Platten M. Protein kinase Cß as a therapeutic target stabilizing blood-brain barrier disruption in experimental autoimmune encephalomyelitis. Proc Natl Acad Sci U S A. 2013 Sep 3;110(36):14735-40.
- Opitz CA, Litzenburger UM, Sahm F, Ott M, Tritschler I, Trump S, Schumacher T, Jestaedt L, Schrenk D, Weller M, Jugold M, Guillemin GJ, Miller CL, Lutz C, Radlwimmer B, Lehmann I, von Deimling A, Wick W, Platten M. An endogenous tumour-promoting ligand of the human aryl hydrocarbon receptor. Nature. 2011 Oct 5;478(7368):197-203.
Kontextspalte
Kontakt

Prof. Dr. Michael Platten
Neurologische Klinik, Universitätsmedizin Mannheim
KKE Neuroimmunologie und Hirntumorimmunologie, DKFZ Heidelberg
Immunmonitoring-Einheit, NCT Heidelberg
Medizinische Fakultät Mannheim
Universität Heidelberg
Theodor-Kutzer-Ufer 1-3
68167 Mannheim
Telefon 0621 383-2885
michael.platten@medma.uni-heidelberg.de
