Sie befinden sich hier
Inhalt
Neuropharmakologie
Das Institut für Psychopharmakologie beschäftigt sich in erster Linie mit der Suchtforschung. Im Mittelpunkt unseres Interesses steht die tierexperimentelle und translationale Erforschung der Alkohol- und Drogensucht. Da süchtiges Verhalten häufig mit anderen psychiatrischen Störungsbildern, insbesondere Angst, Depression, und ADHD, auftritt untersuchen wir auch diese Komorbiditäten. Ferner forschen wir an sozialer Ausgrenzung und Borderline-Persönlichkeitsstörungen.
Sieben Arbeitsgruppen sind an dem Institut für Psychopharmakologie angegliedert: Verhaltenspharmakologie (Spanagel), Verhaltensgenetik (Bilbao), Neuroanatomie (Hansson), Molekulare Pharmakologie (Sommer), Translationale Suchtforschung (Sommer, Kiefer), Physiologie neuronaler Netzwerke (Köhr), und In silico Pharmakologie (Noori).
Basierend auf präklinischen Befunden verfolgen wir drei Ziele:
- die Entwicklung neuer Verhaltenstherapien, pharmakologische Interventionen und Tiefenhirnstimulation bei Suchtpatienten (z.B. Pharmakologische Unterdrückung von Rekonsolidierung eines Drogengedächtnisses)
- die neurobiologischen Langzeitfolgen von Drogenmissbrauch und Komatrinken bei Adoleszenten abzuklären
- die Identifikation von Risikofaktoren für Suchterkrankungen und Entwicklung von präventiven Strategien
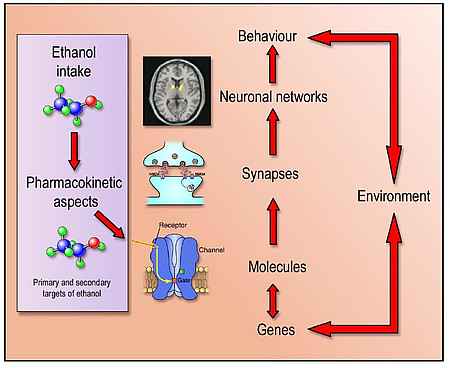
Wir verwenden ein breites Methodenspektrum, um unsere Ziele zu verfolgen. Im verhaltenspharmakologischen Bereich nutzen wir neben einer Vielzahl von Standardmodellen (z.B. Reinstatement Modell) zwei neue Tiermodelle zur Generierung von alkoholsüchtigen bzw. kokainsüchtigen Ratten. Diese Suchtmodelle sind Ausgangspunkt zur Charakterisierung der neuroanatomischen und molekularen Substrate von süchtigem Verhalten. Ferner dienen diese Modelle in Kooperation mit der Pharmaindustrie neue Antirückfallsubstanzen präklinisch zu testen.
Hierbei setzen wir zusätzlich in silico Methoden ein wie z.B. drug repurposing. Ferner erforschen wir Gen x Umwelt Interaktionen die zu einem erhöhten Suchtrisiko beitragen. Hierbei kommen verschiedene transgene Tiermodelle zum Einsatz. In Interaktion mit der Droge und Umweltfaktoren wie z.B. Stressoren. In der translationalen Forschung nutzen wir insbesondere kombinierte Tier- und Human MRI basierte Methoden (Spektroskopie, fMRI, phMRI, mit jeweils 9.4T bzw. 3T Scannern) sowie konvergierende genomische Analysen – hierbei werden Kandidatengene aus genomweiten Assoziationsstudien und differenziellen Genexpressionsanalysen definiert und anschließend in transgenen Rattenmodellen funktionell validiert.
Auswahl aktueller Publikationen
- Bernardi RE, Olevska A, Morella I, Fasano S, Santos E, Brambilla R, Spanagel R (2019) The inhibition of RasGRF2, but not RasGRF1, alters cocaine reward in mice. J Neurosci 39(32):6325-6338
- Noori HR, Mervin LH, Bokharaie V, Durmus Ö, Egenrieder L, Fritze S, Reinhardt G, Schabel HH, Staudenmaier S, Logothetis NK, Bender A, Spanagel R (2018) Systemic neurotransmitter responses to clinically approved and experimental neuropsychiatric drugs. Nat Commun 9(1):4699
- Cannella N, Oliveira AMM, Hemstedt TJ, Lissek T, Bading H, Spanagel R (2018) Dnmt3a2 in the nucleus accumbens shell is required for reinstatement of cocaine-seeking. J Neurosci 38(34):7516-7528
- Noori HR, Schöttler J, Ercsey-Ravasz M, Cosa-Linan A, Varga M, Toroczkai Z, Spanagel R (2017) A multiscale cerebral neurochemical connectome of the rat brain. PLoS Biol 15(7):e2002612
- Hirth N, Meinhardt MW, Noori HR, Salgado H, Torres-Ramirez O, Broccoli L, Vengeliene V, Roßmanith M, Perreau-Lenz S, Köhr G, Sommer WH, Spanagel R, Hansson AC (2016) Convergent evidence from alcohol-dependent humans and rats for a hyperdopaminergic state in protracted abstinence. Proc Natl Acad Sci U S A 113(11):3024-9
- Schneider M, Kasanetz F, Monory K, Leweke FM, Schreckenberger M, Lutz B, Reggio PH, Manzoni OJ, Spanagel R (2015) Enhanced functional activity of the cannabinoid type-1 receptor mediates adolescent behavior. J Neurosci 35(41):13975-88
- Vengeliene V, Leonardi-Essmann F, Sommer WH, Spanagel R (2010) Glycine transporter-1 blockade leads to persistently reduced relapse-like alcohol drinking in rats. Biol Psychiatry 68(8):704-11.
- Engblom D, Bilbao A, Sanchis-Segura C, Dahan L, Perreau-Lenz S, Balland B, Parkitna JR, Luján R, Halbout B, Mameli M, Parlato R, Sprengel R, Lüscher C, Schütz G, Spanagel R (2008) Glutamate receptors on dopamine neurons control the persistence of cocaine seeking. Neuron 59(3):497-508.
- Spanagel R, Pendyala G, Abarca C, Zghoul T, Sanchis-Segura C, Magnone MC, Lascorz J, Depner M, Holzberg D, Soyka M, Schreiber S, Matsuda F, Lathrop M, Schumann G, Albrecht U (2005) The clock gene Per2 influences the glutamatergic system and modulates alcohol consumption. Nat Med 11(1):35-42.
- Sillaber I, Rammes G, Zimmermann S, Mahal B, Zieglgänsberger W, Wurst W, Holsboer F, Spanagel R (2002) Enhanced and delayed stress-induced alcohol drinking in mice lacking functional CRH1 receptors. Science 296(5569):931-3.
Kontextspalte
Kontakt

Prof. Dr. Rainer Spanagel
Institut für
Psychopharmakologie
Leitung
Zentralinstitut für Seelische Gesundheit (ZI)
Quadrat J5
68159 Mannheim
Telefon 0621 1703-6251
rainer.spanagel@zi-mannheim.de
