Sie befinden sich hier
Inhalt
Endothelzellen weisen eine ausgeprägte organ-spezifische Heterogenität auf. Die endotheliale Heterogenität bedingt eine organ-spezifische Differenzierung der mikrovaskulären Nische, an der neben Endothelzellen verschiedene andere Zellpopulationen wie Gefäßwandzellen und Zellen des Organparenchyms und des Gewebestromas, aber auch Stammzellen, beteiligt sind. Die organ-spezifische Differenzierung der mikrovaskulären Nische wird unter anderem durch sogenannte Angiokine vermittelt. Angiokine sind Zytokine, die von Endothelzellen synthetisiert werden und ein organ-spezifisches Sekretionsmuster aufweisen.
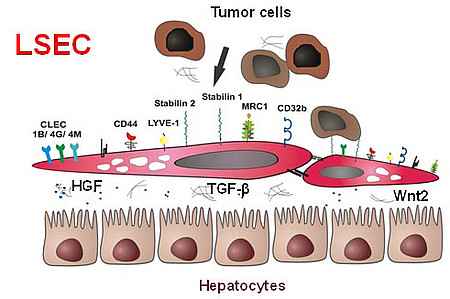
Ein Paradebeispiel für die organ-spezifische Heterogenität der vaskulären Nische stellt das mikrovaskuläre Gefäßbett der Leber dar. Die organ-spezifisch differenzierten Endothelzellen werden hier als Sinus-Endothelzellen der Leber (LSEC) bezeichnet. LSEC unterscheiden sich von normalen Endothelzellen durch ihre besondere Morphologie und eine fehlende Basalmembran. Pathologische Veränderungen dieser spezialisierten, von diskontinuierlichem Endothel ausgekleideten Lebersinusoide tragen zu häufigen, schwerwiegenden Lebererkrankungen – wie der alkoholischen Leberzirrhose – bei.
Auch bei der Hepatokarzinogenese und der Metastasierung ändert sich die Differenzierung von LSEC hin zu einem kapillären Phänotyp (sogenannte Kapillarisierung). Normale Lebersinusoidendothelien (LSEC) weisen eine hohe Endozytosekapazität zur Clearance des Blutes von toxischen Stoffwechselprodukten auf; hierzu sind sie mit einem komplexen Zytoskelett mit Fenestrationen und mit speziellen Endozytose-Rezeptoren ausgestattet.
Darüber hinaus regulieren sie den Pfortaderblutdruck. In den vergangenen Jahren konnte unsere Arbeitsgruppe, teils mittels klassischer Biochemie, teils mittels moderner molekularer Verfahren wie Gene-Profiling-Untersuchungen zahlreiche neue Proteine dieses Zelltyps identifizieren. Stabilin-1 und Stabilin-2, die zunächst als Markerproteine nicht-kontinuierlicher Sinus-Endothelien identifiziert wurden, zeigten in der bioinformatorischen Analyse eine Proteinstruktur, die sie als endozytisch aktive Scavangerrezeptoren klassifiziert. Wir konnten darüber hinaus zeigen, dass die Stabiline einen wesentlichen Beitrag zur Clearance Funktion von LSEC leisten. Als Liganden konnten u. a. Hyaluronsäure, AGE-modified proteins und das extrazelluläre Matrixprotein SPARC, aber auch Zytokine (GDF15) oder Hormone (Placental Lactogen) identifiziert werden.
Zur Untersuchung der Endozytose-Funktionen der Stabiline in vivo haben wir Tiermodelle etabliert, in denen die Stabilin-Gene durch rekombinante Techniken gezielt entfernt wurden („knockout”-Mäuse). Diesen Tieren fehlen entweder Stabilin-1, Stabilin-2 oder beide Stabilin-Gene. Wir konnten zeigen, dass Mäuse mit einer doppelten Defizienz für Stabilin-1 und Stabilin-2 früher sterben und eine massive Fibrose insbesondere der Nieren, aber auch der Leber aufweisen. Diese glomerulofibrotische Nephropathie ist bedingt durch die fehlende Clearance toxischer Substanzen aus dem peripheren Blut durch die Stab1/2-defizienten LSEC.
Unsere Arbeitsgruppe verfolgt aktuell folgende Schwerpunkte zu Untersuchung der zugrundeliegenden Mechanismen und Funktionen der mikrovaskulären Heterogenität der Leber:
- Aufklärung molekularer Mechanismen, die die LSEC-spezifische Differenzierung in der Entwicklung und im adulten Organismus steuern.
- Charakterisierung des Ligandenspektrums der Stabiline und Untersuchung der Bedeutung der Stabilin-vermittelten Clearance für metabolische Erkrankungen.
- Funktionelle Analyse neu identifizierter LSEC-spezifischer Proteine wie Leda-1 und Gata-4. (iv) Untersuchung der Rolle der endothelialen Heterogenität und der organ-spezifischen zellulären und molekularen Interaktionen in der hepatischen vaskulären Nische bei der Metastasierung.
Eigene relevante Publikationen
- Géraud C, Koch PS, Damm F, Schledzewski K, Goerdt S. The metastatic cycle: metastatic niches and cancer cell dissemination. J Dtsch Dermatol Ges, 12: 1012-9, 2014.
- Géraud C, Koch PS, Goerdt, S. Vascular niches: endothelial cells as tissue- and site-specific multifunctional team players in health and disease. J Dtsch Dermatol Ges, 12: 685-9, 2014.
- Géraud C*, Mogler C*, Runge A, Evdokimov K, Lu S, Schledzewski K, Arnold B, Hämmerling G, Koch P, Breuhahn K, Longerich T, Marx A, Weiss C, Damm F, Schmieder A, Schirmacher P, Augustin HG, Goerdt S. Endothelial transdifferentiation in hepatocellular carcinoma: loss of Stabilin-2 expression in peri-tumorous liver correlates with increased survival. Liver International, 33: 1428-40, 2013.
- Géraud C*, Evdokimov K*, Straub BK, Peitsch WK, Demory A, Dörflinger Y, Schledzewski K, Schmieder A, Schemmer P, Augustin HG, Schirmacher P, Goerdt S. Unique cell type-specific junctional complexes in vascular endothelium of human and rat liver sinusoids. PLoS ONE, 7: e34206, 2012.
- Schledzewski K*, Géraud C*, Arnold B, Wang S, Gröne HJ, Kempf T, Wollert KC, Straub BK, Schirmacher P, Demory A, Schönhaber H, Gratchev A, Dietz L, Thierse HJ, Kzhyshkowska J, Goerdt S. Deficiency of liver sinusoidal scavenger receptors stabilin-1/-2 in mice causes glomerulofibrotic nephropathy via impaired hepatic clearance of noxious blood factors. Journal of Clinical Investigation, 121: 703–714, 2011.
- Schmieder A, Schledzewski K, Michel J, Tuckermann JP, Tome L, Sticht C, Gkaniatsou C, Nicolay JP, Demory A, Faulhaber J, Kzhyshkowska J, Géraud C, Goerdt S. Synergistic activation by p38MAPK and glucocorticoid signaling mediates induction of M2-like tumor-associated macrophages expressing the novel CD20 homolog MS4A8A. International Journal of Cancer 129: 122-132, 2011.
- Géraud C*, Schledzewski K*, Demory A, Klein D, Kaus M, Peyre F, Sticht C, Evdokimov K, Lu S, Schmieder A, Goerdt S. Liver sinusoidal endothelium: a microenvironment-dependent differentiation program in rat including the novel junctional protein liver endothelial differentiation-associated protein-1. Hepatology, 52: p. 313-26, 2010.
- Klein D, Demory A, Peyre F, Kroll J, Augustin HG, Helfrich W, Kzhyshkowska J, Schledzewski K, Arnold B, Goerdt S. Wnt2 acts as a cell type-specific, autocrine growth factor in rat hepatic sinusoidal endothelial cells cross-stimulating the VEGF pathway. Hepatology 47: 1018-1031, 2008.
- Kzhyshkowska J, Mamidi S, Gratchev A, Kremmer E, Schmuttermaier C, Krusell L, Haus G, Utikal J, Schledzewski K, Scholtze J, Goerdt S. Novel stabilin-1 interacting chitinase-like protein (SI-CLP) is up-regulated in alternatively activated macrophages and secreted via lysosomal pathway. Blood 107: 3221-3228, 2006.
- Martens JH, Kzhyshkowska J, Falkowski-Hansen M, Schledzewski K, Gratchev A, Mansmann U, Schmuttermaier C, Dippel E, Koenen W, Riedel F, Sankala M, Tryggvason K, Kobzik L, Moldenhauer G, Arnold B, Goerdt S. Differential expression of a gene signature for scavenger/lectin receptors by endothelial cells and macrophages in human lymph node sinuses, the primary sites of regional metastasis. J Pathol 208: 574-589, 2006.
Kontextspalte
Kontakt

Prof. Dr. Sergij Goerdt
Klinik für Dermatologie, Venerologie und Allergologie
Medizinische Fakultät Mannheim
Theodor-Kutzer-Ufer 1-3
68167 Mannheim
Telefon 0621 383-2280
sergij.goerdt@umm.de