Sie befinden sich hier
Inhalt
Einfluss des peroxisomalen Stoffwechsels auf die Homöostase im ZNS
Peroxisomen sind ubiquitäre, multifunktionale Organellen, die für die Aufrechterhaltung des menschlichen Lipidstoffwechsels unverzichtbar sind. Peroxisomale Erkrankungen äußern sich in besonderem Maße in Schädigungen im Bereich des Zentralnervensystems und manifestieren sich als fortschreitende Demyelinisierung peripherer und zentraler Nervenbahnen, Degeneration von Rezeptorzellen in der Retina und dem Corti-Organ oder bereits embryonal in Form von neuronalen Migrationsdefekten.
Dabei werden degenerative neuronale Prozesse besonders beim Fehlen von Peroxisomen in Oligodendrocyten und Hepatocyten der Leber beobachtet, während die Funktion der durchaus zahlreichen Peroxisomen in Neuronen und Astrocyten bisher weitgehend unverstanden ist. Über ihre Zelltyp-spezifische Funktion hinaus demonstriert die peroxisomale Stoffwechselphysiologie damit die Wichtigkeit von metabolischer Interorgan- und interzellulärer Kommunikation, die besonders für die stark polarisierten und metabolisch sensiblen Neuronen maßgeblich ist.
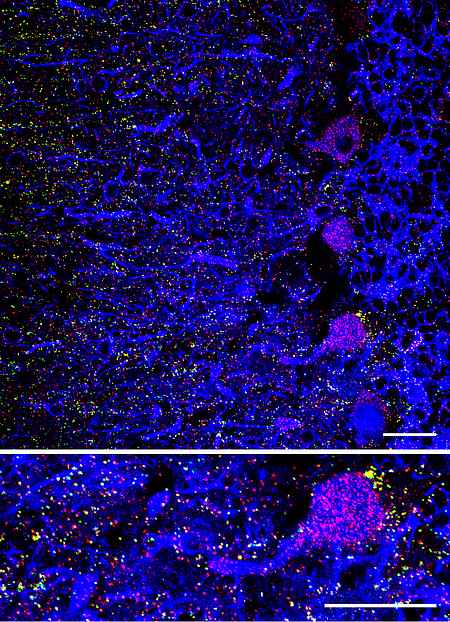
Durch die Identifikation des peroxisomalen Acyl-CoA-bindenden Proteins ACBD5 als molekulare Grundlage für einen Tethering-Komplex mit der Membran des endoplasmatischen Retikulums konnten wir neue mechanistische Erkenntnisse zur interzellulären Kommunikation zwischen diesen beiden metabolisch verknüpften Organellen gewinnen. Mit der Mutation von ACBD5 konnte kürzlich eine neue peroxisomale Erkrankung beim Menschen assoziiert werden, die sich u.a. durch Hypomyelinisierung im Bereich der langen Faserbahnen des Hirnstamms (Pyramidenbahnen, Lemniscus medialis, Pedunculus cerebellaris inferior) und einer Retinadegeneration manifestiert.
Derzeit untersuchen wir die pathophysiologischen Konsequenzen eines ACBD5 Knockouts in Mäusen mit besonderem Fokus auf den Zustand von Retina und Gehirn. Diese Ergebnisse korrelieren wir mit Untersuchungen auf subzellulärer und biochemischer Ebene, die Aufschluss über die von ACBD5 gebildeten Proteinkomplexe und metabolischen Funktionen geben sollen.
Im Fokus unserer Arbeit stehen:
- Klärung der prinzipiellen Funktionen von ACBD5, eines multifunktionalen Proteins, dass zum einen für den Austausch von Lipiden zwischen ER und Peroxisomen verantwortlich (Tethering-Funktion), zum anderen am Import von Fettsäuren in Peroxisomen über seine Acyl-CoA bindende Domäne beteiligt sein könnte.
- Charakterisierung retinaler und neuronaler Defekte im Zusammenhang mit peroxisomaler Insuffizienz am Modell der ACBD5 KO Maus
- Einfluss von Verteilung und Mobilität von Peroxisomen auf die Differenzierung und Stresstoleranz von Neuronen in Hippocampusprimärkulturen
Auswahl aktueller Publikationen
- Darwisch W, von Spangenberg M, Lehmann J, Singin Ö, Deubert G, Kühl S, Roos J,Horstmann H, Körber C, Hoppe S, Zheng H, Kuner T, Pras-Raves ML, van Kampen AHC, Waterham HR, Schwarz KV, Okun JG, Schultz C, Vaz FM, Islinger M. 2020. Cerebellar and hepatic alterations in ACBD5-deficient mice are associated with unexpected, distinct alterations in cellular lipid homeostasis. Commun Biol. 2020; 3, 713.
- Islinger M, Costello JL, Kors S, Soupene E, Levine TP, Kuypers FA, Schrader M. 2020. The diversity of ACBD proteins - From lipid binding to protein modulators and organelle tethers. Biochim Biophys Acta Mol Cell Res. 1867, 118675. doi: 10.1016/j.bbamcr.2020.118675.
- Wang Y, Metz J, Costello JL, Passmore J, Schrader M, Schultz C, Islinger M. 2018. Intracellular redistribution of neuronal peroxisomes in response to ACBD5 expression. PLoS One 13, e0209507. doi: 10.1371/journal.pone.0209507.
- Marcassa E, Kallinos A, Jardine J, Rusilowicz-Jones EV, Martinez A, Kuehl S, Islinger M, Clague MJ, Urbé S. 2018. Dual role of USP30 in controlling basal pexophagy and mitophagy. EMBO Rep. 19, e45595. doi: 10.15252/embr.201745595.
- Costello JL, Castro IG, Camões F, Schrader TA, McNeall D, Yang J, Giannopoulou EA, Gomes S, Pogenberg V, Bonekamp NA, Ribeiro D, Wilmanns M, Jedd G, Islinger M*, Schrader M*. 2017. Predicting the targeting of tail-anchored proteins to subcellular compartments in mammalian cells. J Cell Sci. 130, 1675-1687. (*shared senior authorship)
- Costello JL, Castro IG, Hacker C, Schrader TA, Metz J, Zeuschner D, Azadi AS, Godinho LF, Costina V, Findeisen P, Manner A, Islinger M, Schrader M. 2017. ACBD5 and VAPB mediate membrane associations between peroxisomes and the ER. J Cell Biol. 216, 331-342. (*shared senior authorship)
- Camões F*, Islinger M*, Guimarães S*, Kilaru S, Schuster M, Godinho L, Steinberg G, Schrader M. 2015. New insights into the peroxisomal protein inventory: Acyl-CoA oxidases and -dehydrogenases are an ancient feature of peroxisomes, Biochim Biophys Acta, 1853, 111-25 (*shared first authorship)
- Islinger M, Liebler S., Angermüller, S., Weber G, Li KW, Loos M, Eckerskorn C, Völkl A. 2010. Peroxisomes from the heavy mitochondrial fraction: isolation by zonal free flow electrophoresis and quantitative mass spectrometrical characterization. J Prot Res 9, 113–124.
- Islinger M, Li KW, Seitz J, Völkl A, Lüers GH. 2009. Hitchhiking of Cu/Zn superoxide dismutase to peroxisomes - evidence for a natural piggyback import mechanism in mammals. Traffic 10, 1721–1731.
- Islinger M, Lüers GH, Li KW, Loos M, Völkl A. 2007. Rat liver peroxisomes after fibrate treatment: a survey using quantitative mass spectrometry. J Biol Chem. 282, 23055–23069.
Kontextspalte
Kontakt

PD Dr. Markus Islinger
Medizinische Fakultät Mannheim
Ludolf-Krehl-Str.13-17
68167 Mannheim
Telefon 0621 383-71557
markus.islinger@medma.uni-heidelberg.de
