Sie befinden sich hier
Inhalt
Trotz großer Fortschritte in der pädiatrischen Onkologie in den letzten Jahrzehnten sind Metastasen, die das Zentralnervensystem (ZNS) befallen, immer noch mit schlechten Überlebenschancen verbunden. Um in das ZNS einzudringen, müssen Tumorzellen die spezifischen zellulären Barrieren überwinden, die das ZNS vom Blutkreislauf trennen. Diese Barrieren werden im Wesentlichen von der Blut-Hirnschranke (BHS) und der Blut-Liquorschranke (BLS) gebildet. Da Tumorzellen im ZNS durch die Blut-Hirnschranken weitestgehend vor Chemotherapie geschützt sind, kann es auch nach erfolgreicher Remission zu Rezidiven im ZNS kommen. In diesem Zusammenhang konzentrieren wir uns auf die Erforschung zweier Tumorarten:
- Das Neuroblastom ist die dritthäufigste Krebsart bei Kindern, mit Metastasierung in über 50 % der Fälle. Das Auftreten von ZNS Rezidiven ist in den letzten Jahren immer häufiger geworden, was mit der generell längeren Überlebensdauer der Patienten im Zusammenhang steht. Deshalb ist es von größter Bedeutung herauszufinden, welche molekularen Mechanismen den Eintritt von Neuroblastomzellen in das ZNS vermitteln.
- Die akute lymphoblastische Leukämie (ALL) ist die häufigste Krebsart bei Kindern und Metastasierung in das ZNS häufig. Aus diesem Grund unterlaufen alle Patienten eine prophylaktische Behandlung des ZNS (intrathekale Chemotherapie und/oder kraniale Bestrahlung). Leider sind diese Therapien häufig mit schweren Nebenwirkungen verbunden und es existieren keine verlässlichen molekularen Biomarker, die das Risiko eines Patienten für eine ZNS Metastasierung oder ein ZNS Rezidiv vorhersagen. Diese wären nötig, um Patienten gezielter behandeln zu können und um neue Therapiemöglichkeiten zu entwickeln.
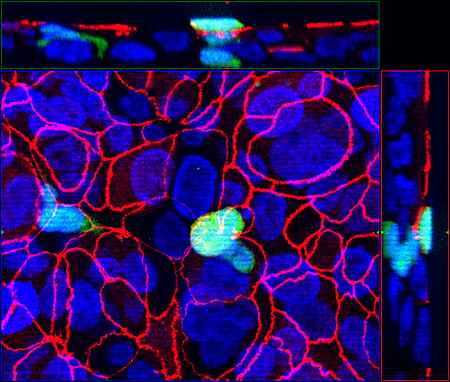
Unser Forschungsschwerpunkt liegt auf der Untersuchung von molekularen Mechanismen, die Tumorzellen nutzen, um die zellulären Barrieren des ZNS zu überwinden. Dadurch können neue Risikofaktoren und therapeutische Angriffspunkte identifiziert werden. Wir konzentrieren uns dabei auf die molekularen Interaktionen zwischen Tumorzellen und funktionellen humanen in vitro Modellen der BHS und der BLS. Im Detail verfolgen wir dazu folgende Ziele:
- Optimierung funktioneller, humaner in vitro Modelle der BHS und der BLS
- Bestimmung des Einflusses von Chemokinen und Zelladhäsionsmolekülen auf die Tumorzelltransmigration
- Aufklärung der Funktion proinflammatorischer Zytokine sowie Chemotherapeutika während der Transmigration der Tumorzellen
Auswahl aktueller Publikationen
- Vandenhaute E, Stump-Guthier C, Lasierra Losada M, Tenenbaum T, Rudolph H, Ishikawa H, Schwerk C, Schroten H, Dürken M, März M, Karremann M. The choroid plexus may be an underestimated site of tumor invasion to the brain: an in vitro study using neuroblastoma cell lines. Cancer Cell Int. 2015 Oct 24;15
- Steinmann U, Borkowski J, Wolburg H, Schröppel B, Findeisen P, Weiss C, Ishikawa H, Schwerk C, Schroten H, Tenenbaum T. Transmigration of polymorphnuclear neutrophils and monocytes through the human blood-cerebrospinal fluid barrier after bacterial infection in vitro. J Neuroinflammation. 2013; 10:31
- Tenenbaum T, Steinmann U, Friedrich C, Berger J, Schwerk C, Schroten H. Culture models to study leukocyte trafficking across the choroid plexus. Fluids Barriers CNS. 2013; 10:1.
- Schneider H, Weber CE, Schoeller J, Steinmann U, Borkowski J, Ishikawa H Findeisen P, Adams O, Doerries R, Schwerk C, Schroten H, Tenenbaum, T. Chemotaxis of T-cells after infection of human choroid plexus papilloma cells with Echovirus 30 in an in vitro model of the blood-cerebrospinal fluid barrier. Virus Res. 2012; 170:66-74.
Kontextspalte
Kontakt

Prof. Dr. Horst Schroten
Klinik für Kinder- und Jugendmedizin
Universitätsmedizin Mannheim
Theodor Kutzer-Ufer 1-3
68167 Mannheim
Telefon 0621 383-2248
horst.schroten@umm.de